Definición de Ecuación de Arrhenius

Ingeniera Química
La ecuación de Arrhenius es una representación matemática utilizada para expresar la dependencia de la constante cinética de una reacción química con la temperatura a la cual puede llevarse a cabo esta reacción.
Esta ecuación es una modificación de la ecuación de Van’t Hoff y se basa en datos empíricos, es decir, experiencias llevadas a cabo y estudiadas para encontrar la correlación que mejor se ajusta.
Para poder comprenderla debemos primero conocerla. De este modo, la expresión se resume a:
![]()
En donde, k es la constante cinética de la reacción, A es el factor de frecuencia (una constante que involucra la frecuencia de colisiones), Ea es la energía de activación (J/ mol) requerida para llevar a cabo la reacción, es decir, la mínima energía necesaria para que haya colisiones efectivas entre moléculas, R (J/ K.mol) es la constante universal de los gases y T es la propiamente la temperatura de reacción.
Cabe destacar que el valor de k, único para una dada temperatura, se puede obtener de la Ley de velocidad de reacción adicionalmente:
![]()
Siendo v la velocidad de reacción, para una reacción de tipo: A + B → C. En donde n y m son los órdenes de reacción respecto a A y B.
Experimentalmente, se observa que la velocidad de una reacción química aumenta al incrementar la temperatura. En tanto que, aumentará la constante de velocidad de reacción al aumentar la temperatura y al disminuir la energía de activación. Sin embargo, observamos que la dependencia entre la constante de velocidad de reacción y la temperatura es exponencial, sin embargo, muchas veces veremos la ecuación modificada a su forma logarítmica, de forma linealizada:
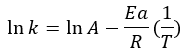
Este modelo nos permite encontrar una regresión lineal donde el eje de las ordenadas se representa ln (k) mientras que en las abscisas (1/T), teniendo como ordenada al origen ln (A) y como pendiente -Ea/R.
Aplicabilidad
En primer lugar y su uso más común es la determinación de la constante de velocidad de la reacción química y, a partir de este valor, también es posible (por Ley de Velocidad) la determinación de la velocidad de reacción. En tanto que, la Ecuación de Arrhenius también es útil para conocer la Energía de Activación y observar la dependencia entre ambos valores.
Por ejemplo, si se determinaron valores de constantes de velocidad de reacción para distintas temperaturas, a partir de la pendiente de la curva ln (k) vs. (1/T) es posible obtener el valor de energía de activación de la reacción.
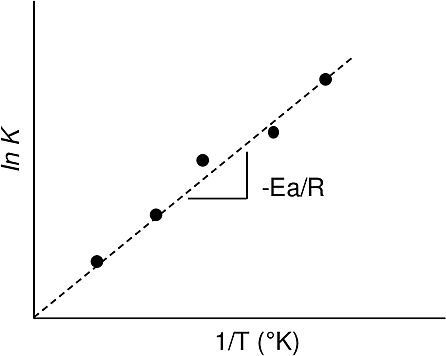
*Ilustración del trabajo «Investigación Aplicada al Procesamiento de Minerales e Hidrometalurgia«, publicado en 2015, por la UAdeC
Aquí se puede ver la linealización planteada anteriormente.
El valor de la Energía de activación nos da una idea de cómo responde la velocidad con respecto a cambios en la temperatura, es decir, una Energía de Activación alta se corresponde a una velocidad de reacción muy sensible a la temperatura (con una pendiente pronunciada), mientras que, una Energía de Activación pequeña corresponde a una velocidad de reacción relativamente poco sensible a variaciones en la temperatura.
En cambio, si se conoce la Energía de Activación y el valor de constante de velocidad de reacción a una determinada temperatura, el modelo permite predecir la velocidad de reacción a otra temperatura dada, ya que para dos condiciones distintas se tiene:
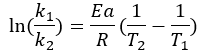
En otros campos, como la ingeniería de los materiales y de los alimentos, esta Ecuación se ha desarrollado e implementado en modelos que permiten predecir propiedades y comportamientos a partir de cambios en las temperaturas de reacción.
Así mismo, esta Ecuación se utiliza en el campo de la electrónica para el estudio de las baterías de hidruros metálicos y su vida en servicio. Además, esta Ecuación fue desarrollada para la obtención de coeficientes difusivos, velocidades de fluencia y otros modelados térmicos.
Limitaciones
La limitación más difundida de esta Ecuación es su aplicabilidad únicamente en soluciones acuosas. Aunque la misma fue modificada para ser aplicada a sólidos, en principio, fue planteada para soluciones cuyo solvente sea agua.
Así mismo, cabe destacar que es un modelo empírico y no exacto, basado en múltiples experiencias y resultados estadísticos.

Trabajo publicado en: Jun., 2022.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.