Definición de Termodinámica

Licenciado en Física
1. Leyes físicas en torno a las formas en que el calor interactúa y se comporta con otras fuentes de energía, el modo en que la energía se transforma, y la posibilidad para hacer un trabajo.
Etimología: Formado por el prefijo termo-, por la referencia en el griego θερμο- (thermo-), que remite a ‘calor’, y dinámica, por el griego δυναμικά (dynamiká), femenino de δυναμικός (dynamikós), respecto de δύναμις (dýnamis), en cuanto ‘fuerza’, ‘poder’.
Cat. gramatical: Sustantivo fem.
En sílabas: ter-mo-di-ná-mi-ca.
Termodinámica
 La termodinámica es la rama de la física que se encarga del estudio de la energía térmica (muchas veces también conocida como “energía interna”) de los sistemas físicos.
La termodinámica es la rama de la física que se encarga del estudio de la energía térmica (muchas veces también conocida como “energía interna”) de los sistemas físicos.
Los fenómenos termodinámicos forman una parte importante de nuestro día a día: cuando calentamos comida, al abrigarnos si está frío en el exterior, o si entramos a un lugar con aire acondicionado, estamos experimentando la termodinámica de primera mano.
Ley Cero de la Termodinámica
Todos los sistemas macroscópicos poseen una propiedad llamada “temperatura” que es una medida de la energía interna que poseen y que es diferente al cero absoluto (- 273 °C). Los cuerpos siempre tienden a encontrar el equilibrio con su entorno y/o con otros cuerpos con los que tengan contacto, cuando dos cuerpos que tienen distintas temperaturas entran en contacto siempre van a alcanzar lo que se conoce como “equilibrio térmico”, es decir, un punto en el cual ambos cuerpos igualan su temperatura.
Esto es lo que se conoce como “la ley cero” de la Termodinámica, la cual establece: Si dos cuerpos A y B se encuentran cada uno en equilibrio térmico con un tercer cuerpo C, entonces los cuerpos A y B también se encuentran en equilibrio térmico entre ellos.
Lo que nos quiere decir esta ley de la termodinámica es precisamente que los cuerpos siempre tienden a igualar sus temperaturas y alcanzar el equilibrio térmico. Esta ley ha sido probada experimentalmente una y otra vez, además, nosotros la experimentamos constantemente. Por ejemplo, al agregarle hielo a una bebida comienza a haber una transferencia de energía térmica en forma de calor de la bebida hacía el hielo, esta transferencia de calor hace que el hielo eleve su temperatura hasta alcanzar su punto de fusión y que se derrita, el resultado final es que el sistema de bebida-hielo alcanzar su equilibrio térmico.
Primera Ley de la Termodinámica
Se le conoce como “calor” a la transferencia de energía entre un sistema y su entorno debida a la diferencia de temperatura que existe entre ambos. De esta manera, si un sistema tiene una temperatura mayor a la de su entorno, perderá energía en forma de calor, y viceversa. Todo esto hasta alcanzar el equilibrio térmico con su entorno tal y cómo lo indica la ley cero de la termodinámica.
Cuando un sistema evoluciona de un estado inicial a uno final, existe una transferencia de calor entre dicho sistema y su entorno, pero también el sistema realiza trabajo mecánico sobre su entorno, todo esto depende de la naturaleza del proceso. Es así, que se define la primera ley de la termodinámica:
ΔU = ΔQ – ΔW
Donde ΔU es el cambio en energía interna del sistema, ΔQ es la transferencia de calor y ΔW es el trabajo mecánico. Esta ley establece que la energía interna de un sistema tiende a incrementar si dicha energía es agregada en forma de calor y tiende a decrecer si se pierde energía en forma de trabajo mecánico realizado por el sistema.
Segunda Ley de la Termodinámica
La naturaleza está llena de procesos que son irreversibles. Por ejemplo, si un vaso de vidrio se cae al suelo se rompe en varios pedazos, sin embargo, nunca vamos a ver que un vaso roto se vuelva a armar espontáneamente y vuelve a su lugar original. La clave para entender por qué algunos procesos son irreversibles está en una cantidad conocida como “entropía”.
La primera ley de la termodinámica establece que en todos los procesos termodinámicos existe una conservación de la energía, sin embargo, esta ley no establece la “dirección” hacía la cuál ocurren dichos procesos. La entropía establece la dirección a la que ocurren los procesos termodinámicos y si estos son o no reversibles. La entropía se define como:
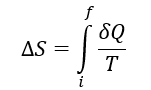
Donde ΔS es el cambio de entropía, Q es la energía transferida desde el sistema o hacía el sistema en forma de calor y T es la temperatura del sistema. La segunda ley de la termodinámica establece que la entropía de un sistema cerrado siempre aumenta para procesos irreversibles o se mantiene constante para procesos reversibles, la entropía nunca decrece.
ΔS ≥ 0
En el mundo real, casi todos los procesos son irreversibles debido a factores como la fricción, las turbulencias, entre otros, de tal manera que la entropía de un sistema cerrado real siempre aumenta. Los procesos en los que la entropía se mantiene constante son siempre idealizaciones.
El salto a la mecánica estadística
La mecánica estadística es la rama de la Física que estudia los sistemas macroscópicos utilizando las herramientas de la probabilidad y la estadística. La relevancia de la mecánica estadística radica en que establece conexiones entre procesos que ocurren microscópicamente con magnitudes termodinámicas que pueden ser medidas macroscópicamente.
De esta manera es que la magnitud macroscópica conocida como temperatura, es una medida de la energía cinética promedio que poseen las moléculas que componen un sistema. La presión de un gas no es más que una manifestación del momento lineal promedio de las partículas que lo componen.
La conexión más interesante entre la mecánica estadística y la termodinámica ocurren cuando se trata con el concepto de entropía. Para la mecánica estadística la entropía es una medida del grado de desorden que posee un sistema, la entropía en la mecánica estadística se expresa como:
S = kB log Ω
Donde kB es la constante de Boltzmann y Ω es el número de microestados del sistema en un momento dado. Es así que la entropía deja de ser un concepto tan abstracto y la segunda ley de la termodinámica puede interpretarse como que los sistemas físicos siempre tienden al desorden.

Art. actualizado: Agosto 2022; sobre el original de marzo, 2022.
Referencias
David Halliday, Robert Resnick & Jearl Walker. (2011). Fundamentals of Physics. United States: John Wiley & Sons, Inc.Gilbert W. Castellan. (1983). Fisicoquímica. Massachusetts: Addison-Wesley.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.