Definición de la Ley de Raoult

Ingeniera Química
Es una de las leyes de la química, desarrollada por el francés Raoult, en donde se establece que la presión de vapor parcial de un componente que forma una mezcla es igual al producto de la presión parcial de ese mismo componente puro por la fracción molar de él en la mezcla.
Quizás, resulte necesario redefinir el concepto de presión de vapor, entendiendo a esta como la presión ejercida por la fase gaseosa sobre una fase líquida (ambas en equilibrio), a una determinada temperatura en un sistema cerrado. Este equilibrio dinámico se alcanza más rápido cuanta mayor sea la superficie de contacto entre las fases y, en esta condición, hablamos de fases saturadas, tanto vapor como líquido saturado.
Esta ley sentó una de las bases fundamentales de la termodinámica en 1887 y, siguiendo la lógica de la Ley de Raoult, vemos que la presión de vapor de una sustancia desciende en su valor cuando pasa de ser pura a ser parte de una mezcla. En función de lo anterior, la expresión matemática de la misma es la siguiente:
Pi = xiL Pi0
Esto se traduce a que la presión parcial de vapor de una sustancia i en una mezcla, P_i, es igual a presión de vapor del componente puro, Pi0, (a la misma temperatura) por su fracción molar en fase líquida, xiL.
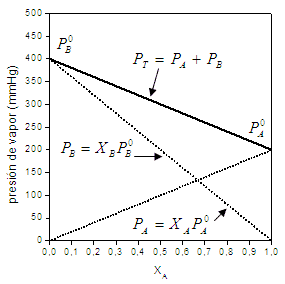
Al hablar de esta Ley, nos referimos a gráficos típicos como este:
Este simple gráfico resulta muy útil para la estimación de presiones parciales de vapor cuando una sustancia se encuentra formando parte de una mezcla, también nos permite describir la composición de solventes volátiles de una mezcla, en su fase gaseosa como así también otras tantas aplicaciones.
La expresión matemática de la Ley de Raoult fue indicada en cada gráfico para los componentes de la mezcla A y B, en este caso, una mezcla binaria formada por dos sustancias puras. Sobre el eje de las abscisas observamos las fracciones molares correspondientes a cada componente (en fase líquida), teniendo hacia la izquierda mayor cantidad de componente B y, en proporción menor cantidad de componente A hasta llegar a que la fracción molar del componente B es 1 y la de A es 0. En tanto que, hacia la derecha, la fracción del componente A va en aumento, hasta obtener únicamente componente A (xA=1). Sobre el eje de las ordenadas, respectivamente se tiene las presiones de vapor de los componentes puros, es decir, cuando únicamente se tiene componente A (xA=1) se tiene la presión de vapor de este mismo componente y, a la inversa ocurre sobre el eje de ordenadas de la izquierda. En la transición, la presión total de la mezcla en fase gaseosa, no se corresponde a la presión de vapor de cada uno de los componentes sino más bien a la suma de la presión parcial de sus componentes (Ley de Dalton), siendo cada una de ellas estimada a partir de la ley de Raoult.
Cabe destacar que, la Ley original tiene modificaciones basadas en las desviaciones de la idealidad de sus compuestos. Cuando, en función de las fuerzas intermoleculares que entren en juego, existan interacciones entre ambas sustancias, esto genera desviaciones, ya que habrá mayor o menos tendencia de uno de ellos a permanecer en fase líquida o no.
En resumen, cuando la desviación es negativa respecto de la Ley ideal de Raoult, las fuerzas intermoleculares en la disolución son mayores que en los componentes puros, por lo tanto, la presión total será menor a la estimada. Esto se traduce en que las fuerzas adhesivas son más fuertes que las fuerzas cohesivas, lo que implica que los componentes son retenidos en fase líquida de la mezcla por fuerzas de atracción mayores que las de los líquidos puros. En cambio, si la desviación es positiva, la presión total será mayor a la estimada ya que las fuerzas intermoleculares en la disolución son menores que en los componentes puros. Aquí, las fuerzas cohesivas entre moléculas son más importantes que las fuerzas adhesivas, por ende, los componentes tienen más facilidad para pasar a fase gaseosa.
Principalmente, la Ley de Raoult es aplicada en técnicas industriales y a escala laboratorio, en procesos como la destilación y la destilación fraccionada.

Trabajo publicado en: Feb., 2022.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.