Definición de Geometría Molecular

Ingeniera Química
Es la estructura de una molécula que determina la disposición tridimensional de los átomos que la forman en el espacio.
Las geometrías moleculares se definen, actualmente, en función de la Teoría de Repulsión de Pares Electrónicos de la Capa de Valencia (TRPECV). Esta teoría permite predecir el comportamiento químico de las sustancias (específicamente covalentes) y ayuda a comprender la distribución electrónica, dando lugar a la geometría de la molécula. Esto, a su vez, nos permite comprender muchas de las propiedades que adquieren las sustancias.
Esta Teoría se basa en una serie de pilares fundamentales que revisaremos para luego, intentar comprender su aplicación práctica. En primer lugar, los electrones enlazados y no enlazados (de valencia) son pensados como un mar de electrones que, por poseer el mismo tipo de carga, se repelen, por lo que siempre se ubicarán lo más alejados del átomo central de la molécula.
En segundo lugar, este “mar” de electrones o “nube electrónica” forma zonas de altas densidades electrónicas, que se constituyen en enlaces, donde los electrones se comparten o bien en pares de electrones no compartidos. A su vez, los enlaces que se forman pueden ser simples, dobles o incluso, triples.
Por último, para determinar la geometría molecular, es de gran ayuda contar con la Estructura de Lewis, en donde se contará la cantidad de densidades electrónicas que hay alrededor del átomo central y esto dará indicio del nombre de su geometría y la forma que adopta la molécula tridimensionalmente.
Cabe destacar que estas densidades se ubicarán lo más alejadas entre sí posible, de forma de adoptar la estructura más estable y donde haya menor repulsión. Es así como, primero se identifica la geometría electrónica y luego, la geometría molecular.
Seis niveles de densidad
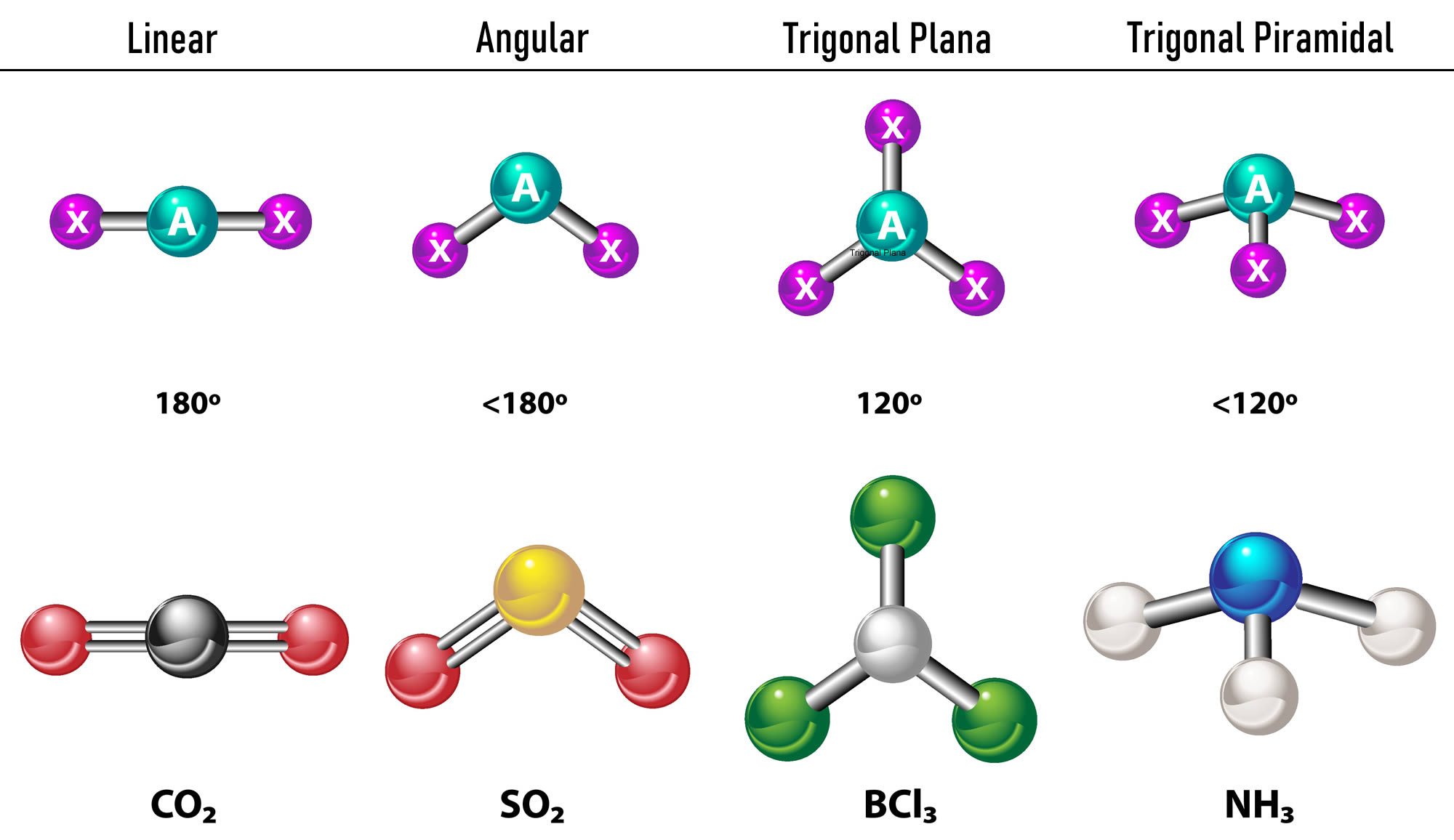
En el caso que se tengan dos densidades electrónicas alrededor del átomo central, los enlaces se ubicarán lo más alejados entre sí, es decir a 180º uno del otro y, por ende, su geometría electrónica es lineal y molecularmente también es lineal.
En el caso que se tengan tres densidades electrónicas alrededor del átomo central, hay dos opciones: tres enlaces o bien dos enlaces y un par no enlazado. Si hay tres enlaces, la geometría electrónica es Trigonal Plana, con ángulos de 120º entre enlaces y geometría molecular toma el mismo nombre. Ahora bien, si la hay un par no enlazado, estos se repelen con más intensidad que las cargas enlazadas, por lo tanto, tienden a comprimir los ángulos de enlace. El ángulo entre el par libre y cada enlace es de 120º y la geometría electrónica es Trigonal Plana mientras que la geometría molecular es Angular.
En el caso que se tengan cuatro densidades electrónicas alrededor del átomo central la geometría electrónica es tetraédrica. Si los cuatro pares de electrones se encuentran enlazados, su geometría molecular coincide en nombre con su geometría electrónica y el ángulo de enlace es de 109.5º. Ahora bien, si uno de los pares es libre, el ángulo de enlace se achica (107º) y la geometría molecular es tipo Pirámide Trigonal. Por último, si dos son pares libres y dos son enlazados, el ángulo de enlace es de 104.5º mientras que la geometría molecular se denomina Angular.
Cuando las densidades electrónicas alrededor del átomo central ascienden a cinco, se denomina una Bipirámide Trigonal su geometría electrónica. Si todas las cargas están enlazadas, se tienen ángulos de 120ºC entre los enlaces ubicados equatorialmente y 90º entre los axiales con los equiatoriales. Ahora bien, la geometría molecular también es denominada Bipirámide Trigonal mientras que, al tener cuatro pares enlazados y uno libre la geometría molecular se distorsiona formando el conocido “balancín”, allí el nombre que adquiere es Tetraedo Distorsionado. En tanto que, si dos de los cinco pares de electrones están libres y tres de ellos enlazados, se tiene una geometría en forma de “T” y su nombre se debe justamente a su estructura. Por último, si es a la inversa, tres pares libres y dos cargas enlazadas la geometría molecular es lineal.
Finalmente, se tienen seis densidades electrónicas alrededor del átomo central y se forma un octaedro y de allí su nombre en la geometría electrónica. De igual forma, se nombre la geometría molecular si todos sus pares están enlazados. Si se tienen cinco pares enlazados y uno libre la geometría molecular es Pirámide de Base Cuadrada. Si se tienen cuatro pares enlazados y dos libres la geometría molecular es Cuadrada Plana.

Trabajo publicado en: Ene., 2022.
Figura: Sweet Nature
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.