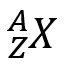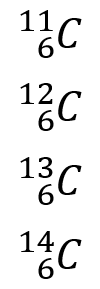Definición de Estructura Atómica

Ingeniera Química
Es la forma en que se compone un átomo. Al hablar de átomos nos referimos a las partículas más pequeñas que pueden conservar las propiedades de un determinado elemento.
Según la Tabla Periódica, existen aproximadamente 118 clases de átomos distintos y que, al agruparse forman moléculas. La estructura del átomo fue estudiada por distintos científicos hasta llegar a lo que hoy tomamos como criterio general, que es que un átomo está formado por dos zonas bien diferenciadas: la zona nuclear y la zona extra nuclear.
La zona nuclear está formada por la carga positiva (protones) y cargas neutras (neutrones), es por ello por lo que, conforma casi el 99.99% de la masa atómica a pesar de tener un tamaño reducido de 10-12 cm. Las partículas en su interior se mantienen unidas por fuerzas nucleares, fuerzas muy intensas que dan lugar a la Energía Nuclear.
A pesar de contar con la menor masa atómica, la zona extra nuclear ocupa el 99.99% del volumen del átomo, y se encuentra cargada negativamente siendo la zona hospedadora de electrones, que están en continuo movimiento de manera indefinida.
Cuando el átomo es neutro se dice que el número de electrones y protones son iguales. Ahora bien, cuando un átomo pierde o gana electrones quedando cargado positiva o negativamente se forman especies iónicas llamadas cationes y aniones. Dependiendo de la cantidad de electrones que gane o pierda se les asigna el nombre, por ejemplo, el caso del Aluminio, que es un metal que forma un ión positivo, ya que pierde tres electrones, se lo denomina catión trivalente.
Si observamos las masas de las partículas subatómicas veríamos que son similares en el orden los protones y neutrones mientras que los electrones tienen una masa menor, todas ellas definidas en la Tabla Periódica en la unidad de “uma”. “uma” significa “Unidad de Masa Atómica” y es definida como la doceava parte de la masa atómica del carbono, para establecer una magnitud de referencia. A su vez, está definida como la siguiente equivalencia:
1 uma = 1.66 x 10-24 gramos
Si observamos los órdenes de magnitud, dan cuenta que es un valor ínfimo e imperceptible a la visión humana. Entonces al leer la masa atómica de un elemento, por ejemplo, en el caso del Helio vemos que es 4.002602 umas o, lo que es lo mismo, 6.64×10-24 gramos.
Al definir la estructura atómica de un elemento hacemos referencia a dos números conocidos que nos permiten identificar rápidamente el átomo al que estamos nombrando. Estos números son: el número atómico y el número másico.
El número atómico o “Z” representa la cantidad de protones que posee el átomo en su núcleo. Como dijimos anteriormente, si el átomo es neutro, “Z” también se corresponde con el número de electrones en zona extra nuclear. Gracias a su número “Z” lo podemos ubicar en la Tabla Periódica, lo cual le conferirá una serie de propiedades determinadas. En cuanto al número másico o “A” se refiere a la cantidad de protones y neutrones que posee el átomo en su núcleo. En general, ambos números se expresan de la siguiente manera:
Donde X representa el símbolo del elemento químico.
Si bien para un determinado “X”, “Z” es único, “A” puede variar debido a la existencia de isótopos.
Los isótopos son átomos del mismo elemento que difieren en la cantidad de neutrones. Por ello, podrán tener mismo “Z”, es decir, misma cantidad de protones, pero no así mismo “A” ya que los neutrones de uno a otro varían.
Hay muchos ejemplos de isótopos en la naturaleza, los más difundidos son los isótopos del Carbono. Se tienen las siguientes estructuras atómicas para un mismo elemento:
Como vemos, en cada uno de ellos, varía la cantidad de neutrones. Todas las especies conservan seis protones mientras que la primera tiene 5 neutrones, la segunda 6, la tercera 7 y la última 8. Dependiendo del isótopo es que se determina el uso. Por ejemplo, el isótopo Carbono-13 es el menos disponible en la naturaleza a pesar de ser estable físicamente. El carbono-14 es un isótopo radioactivo con aplicaciones en ese campo y el grafito es uno de los isótopos con más utilidad actualmente.

Trabajo publicado en: Ene., 2022.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.