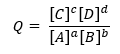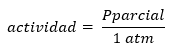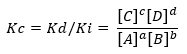Definición de Equilibrio Químico

Ingeniera Química
1. Condición de estabilidad presente en reacciones reversibles donde las velocidades de reacción directa e inversa permanecen siempre las mismas.
Cat. gramatical: Sustantivo masc.
En sílabas: e-qui-li-brio + quí-mi-co.
Equilibrio Químico
Una reacción está en equilibrio químico cuando la velocidad de reacción directa es igual a la velocidad de reacción inversa. Toda reacción química tiene cierta espontaneidad hacia el equilibrio, y para investigarlo lo hacemos a través del signo de ∆G, Energía Libre de Gibbs, lo que implica que, a través del valor de esta magnitud podemos predecir si una reacción ocurrirá en determinado sentido o no.
La variación de la Energía Libre de Gibbs se expresa, en general, en condiciones estándares como la diferencia entre las energías de productos y reactivos también en estado estándar:
Mientras que, si la reacción ocurre en condiciones no estándares, la relación entre ∆Gº y ∆G queda determinada por la siguiente expresión:
Donde Q es el cociente de reacción.
Para comprender la implicancia de la velocidad de reacción y el equilibrio químico debemos estudiar el signo de ∆G:
Si ∆G es negativo, implica que la reacción es espontánea (ocurre) en el sentido directo.
Si ∆G es positivo, implica que la reacción no es espontánea (no ocurre) en el sentido directo.
Mientras que, si ∆G=0, no habrá cambio, puesto que el sistema está en equilibrio, y como ya se mencionó, la velocidad de reacción directa es igual a la velocidad de reacción indirecta. Esto implica que el cociente de reacción Q es igual a la constante de equilibrio K, por lo que no hay una tendencia de favorecer un sentido específico de la reacción.
Dado que Q se define como:
Para una reacción genérica:
Mientras que K toma la misma forma, pero con las concentraciones en equilibrio.
Si volvemos al caso donde ∆G es negativo, esto implica que el cociente de reacción Q es menor que K (constante de equilibrio), implica que las concentraciones de producto son menores que las que debería haber si la reacción estuviese en equilibrio. Por ello, en términos de espontaneidad, se vuelve espontánea en el sentido directo.
En tanto que, si ∆G es positivo, habrá una preponderancia de productos por encima de los que debería haber si el sistema estuviese en equilibrio, siendo Q mayor a K. Por ello, la reacción es espontánea en el sentido inverso.
Cabe destacar que la definición estricta de Q y K se da en términos de actividades de los productos y reactivos, definiendo la actividad en términos de concentración o de presiones como:
O bien:
De allí surge que tanto Q como K son adimensionales y puede plantearse tanto en concentraciones como presiones parciales.
Cuando las concentraciones o presiones parciales de productos y reactivos se mantienen constantes en el tiempo, se da la situación equilibrio químico, en tanto que se llega a una situación de equilibrio dinámico porque la velocidad de reacción directa e inversa con idénticas. Resulta importante resaltar la dinamicidad del equilibrio, la velocidad con la que se forman y se consumen productos y reactivos es la misma, por ello es que las concentraciones o presiones parciales no varía.
Si la condición se aleja de la situación de equilibrio, preponderarán ciertas especies por sobre otra y de allí surge la expresión que relaciona la velocidad de reacción directa e inversa, Kc:
Supongamos la reacción vista anteriormente:
Siendo Kd y Ki, las constantes de velocidades de reacción en el sentido directo o inverso respectivamente.
Nuevamente, si Kc>1, implica que Ki es menor que Kd, por lo que, existe un alto grado de conversión de productos en reactivos. En este caso, el equilibrio está desplazado hacia productos.
Inversamente ocurre si Kc<1, implicando que la velocidad de reacción directa es menor que la velocidad de reacción indirecta y hay un escaso consumo de reactivos, el equilibrio está desplazado hacia reactivos.
En tanto que, si Kc=1, las velocidades son iguales y el sistema se encuentra en equilibrio.
Es importante definir dos cuestiones: en primer lugar, el valor de esta constante depende exclusivamente de la temperatura y, a su vez, varía según la magnitud utilizada para expresar las concentraciones o presiones de productos y reactivos.
Por último, la ley de equilibrio químico se ajusta a soluciones diluidas o gases sometidos a baja presión.

Trabajo publicado en: Dic., 2021.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.