Definición de Diagrama de Fases

Ingeniera Química
El diagrama de fases es la representación visual de la dependencia de la temperatura y la presión de una sustancia pura en un sistema cerrado. Explica los cambios en los estados de agregación de la materia en función de la presión y la temperatura a la cual esté sometida la sustancia.
Previamente, es aconsejable comprender a qué nos referimos con cambios en el estado de agregación. Son específicamente los cambios de estado o de fase. Cuando una sustancia es sencilla, como los fluidos moleculares, se tienen puntos de fusión y ebullición bien definidos. Mientras que, cuando las masas molares aumentan, estas temperaturas se vuelven rangos o más bien, intervalos, entre los que ocurre el cambio de fase.
Inclusive, en muchos casos, no se llega a determinadas temperaturas de cambio de fase, puesto que las sustancias se descomponen previamente. Definimos los siguientes cambios de fases que se ubicarán en los diagramas:
– Evaporación: de líquido a gas.
– Condensación: de gas a líquido.
– Sublimación: de sólido a gas.
– Sublimación inversa: de gas a sólido.
– Solidificación: de líquido a sólido.
– Fusión: de sólido a líquido.
En general, son procesos térmicos, requieren de la absorción o la entrega de energía para que ocurran, por lo que, a medida que se le agrega o se le quita energía nos iremos moviendo a lo largo del diagrama de fases para ver en qué estado de agregación se encontrará la sustancia.
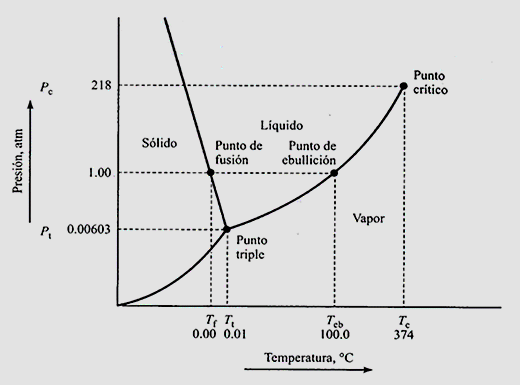
Como bien sabemos, cada sustancia es única, por lo que cada sustancia tendrá su propio e inequívoco diagrama de fases. Por lo que, en cada diagrama se presentará un punto triple, donde se indica la presión y la temperatura a la cual coexisten las tres fases (sólido, líquido y gas) en equilibrio. Así mismo, se presenta un punto crítico, extremo superior en la curva del vapor o gas, este punto indica que a temperaturas mayores no puede llevarse a estado líquido más allá de continuar aumentando la presión del gas.
En general, los diagramas de fases son representados de la siguiente manera:
Aquí se observa, un esquema en donde la presión se ubica en el eje de las ordenadas y la temperatura en el eje de las abscisas. En general, también pueden colorearse las zonas para una mejor visualización. A la izquierda del gráfico la materia se encuentra en estado sólido y, a medida que se aumenta la temperatura (es decir, se incrementa la energía entregada al sistema) se observa un cambio de fase a líquido y luego, de líquido a vapor. Siempre y cuando, nos movamos por encima del punto triple. Por debajo del punto triple, el cambio de fase es directo de sólido a vapor o a la inversa según ocurra la entrega o la quita de energía.
Cada una de las curvas representadas son las curvas de equilibrio. Por ejemplo, la curva que va desde el punto triple al punto crítico es la curva de equilibrio líquido – vapor, mientras que la curva que se encuentra a la izquierda es la curva de equilibrio líquido – sólido. Por debajo se tiene el equilibrio sólido – vapor, ya que a bajas temperaturas y presiones se representa la presión de vapor del sólido. Cada una de estas curvas de equilibrio representan los cambios de fase que fueron nombrados más arriba.
El diagrama de fases representado es específicamente el diagrama de fases del agua, observando que, a presión de 1 atm, el punto de ebullición es de 100ºC (punto de ebullición normal) y la temperatura de fusión es 0ºC (punto de fusión normal). Se observa el punto crítico con una temperatura crítica de 374ºC y una presión crítica de 218 atm mientras que el punto triple, donde coexisten los tres equilibrios se da 0.00603 atm y 0.01ºC.
Además, podemos observar que, si incrementamos la presión, el punto de fusión disminuye mientras que la temperatura de ebullición aumenta, esto es así debido a las pendientes de cada una de las curvas de equilibrio.
Como mencionamos previamente, cada sustancia tiene su propio diagrama de fases, por lo que, la tendencia mencionada puede que no se replique en todos los casos de estudios ya que las pendientes de las curvas de equilibrio varían.

Trabajo publicado en: Dic., 2021.
-
HECTOR MUÑOZ Dic., 2023
BUENAS, MUY BUENA SU EXPLICAION DEL TEMA.
Comentarios
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el concepto.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.