Definición de Pila/Celda Galvánica (Electroquímica)

Ingeniera Química
Una celda galvánica comprende reacciones espontáneas de tipo redox (óxido – reducción) a partir de las cuales se libera energía, conforme la transformación en electricidad. Cuando hablamos de celdas galvánicas nos referimos a tres tipos de pilas principales: primarias (los reactivos ya se encuentran “cargados” en su interior), secundarias (que permiten recargarse) y de combustible. A su vez, dentro de cada uno de estos tipos de pilas existen subclasificaciones.
La electroquímica estudia las reacciones químicas relacionadas con la electricidad, y de ese modo, trabaja con dos tipos de reacciones redox. Cuando la reacción es espontánea se lleva a cabo en una celda galvánica o pila y se produce electricidad; en cambio, cuando se trabaja con reacciones no espontáneas se habla de electrólisis y este proceso se lleva a cabo en celdas electrolíticas.
En el caso de una pila, se utiliza una reacción espontánea para generar electricidad, por ejemplo, cuando se pone en contacto una lámina de Zn (sólido) con una solución que contiene iones Cu+2 (por ejemplo, sulfato cúprico) se observan depósitos de cobre alrededor de la superficie metálica. Estos depósitos color rojizo son fácilmente identificables y se generan espontáneamente, sabiendo que la reacción que se lleva a cabo es la siguiente:
Zn(s) + Cu+2(ac) ⟶ Cu(s) + Zn+2(ac)
En donde el Zn(s) se oxida pasando a Zn+2 en solución y el Cu+2 disuelto en la solución se reduce precipitando como Cu(s). A nivel atómico se identifica la transferencia de electrones desde la especie Zn a los cationes Cu+2, mientras que los iones Zn+2 que se van formando se disuelven en la solución.
En este caso, las cuplas Cu+2 / Cu y Cn+2 / Zn participan de una reacción espontánea que libera energía a partir de la transferencia de electrones generando un trabajo eléctrico. Cuando los electrones que viajan de un lugar a otro pueden hacerlo a través de un camino preparado, se puede aprovechar esa energía liberada. A partir de allí surge la idea de pilas o celdas galvánicas.
Estructura de una pila
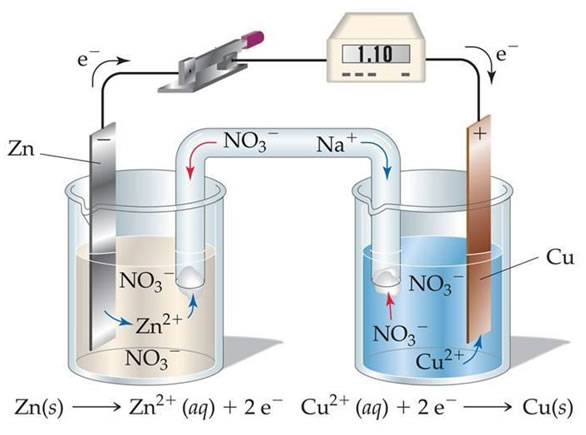
La pila consta básicamente de dos recipientes en donde se separan los reactivos y se colocan las soluciones de trabajo. Por un lado, se tiene el electrodo negativo (por convención), el ánodo, que en este caso es de Zn (s) mientras que en el otro extremo se tiene un electrodo positivo, el cátodo, que es de Cu (s). Estos electrodos son sumergidos en un electrolito (solución) y se encuentran conectados mediante un cable. Cada una de estas semiceldas entonces serán los lugares donde se produzcan las hemi-reacciones de reducción y oxidación pertinentes.
En el ánodo se produce la oxidación mientras que en el cátodo la reducción y, dado que en el ánodo se pierden electrones se utiliza el signo negativo. El cátodo tendrá entones el signo opuesto y lleva a cabo la reacción de reducción. En cuanto a los electrodos, si participa un metal de la semireacción, el material será este metal. Caso contrario, se utilizan materiales inertes como platino o carbono grafito.
A su vez, una pila cuenta con un puente salino (en la figura está formado por una solución de iones Na+ y NO3– ) y debe estar formado por cualquier solución que contenga iones que sean capaces de transportar cargas (electrolitos). Este puente salino tiene la función de estabilizar las cargas, balanceándolas y compensando los consumos y la producción de electrones en cada semireacción. En general, el material de este puente salino es un sólido (pasta, polímero, etc) embebido en el electrolito líquido. Si por la reacción espontánea se forma un catión, se perdieron electrones en el ánodo, por lo que, es necesario que (para compensar las cargas) aniones migren hacia este electrodo. De esta forma, el puente salino que es un tubo en “U” tiene la función de permitir la migración de cargas de un lado a otro.
La pila de la figura representa la reacción mencionada anteriormente, en donde la oxidación del Zn se produce en el ánodo y la reducción del cobre en el cátodo y se conoce como la Pila de Daniell, gracias a su descubridor. En la Pila de Daniel la representación es la siguiente:
Zn / Zn+2 // Cu+2 / Cu
Separando los electrodos (ánodo y cátodo) a través del puente salino representado como “//”.
Tipos de pilas
Pilas primarias
En el caso de las celdas primarias, los reactivos se encuentran dentro de un recinto que está sellado y vienen precargados. Esto implica que, una vez que la reacción llegó a su equilibrio, la pila “se agota” y debe descartarse. Actualmente, en el mundo existen los famosos “come pilas” donde puede descartarse este tipo de material electrónico para generar el menor residuo y contaminación posible al medio ambiente, propiciando su reutilización.
Dentro de las pilas primarias encontramos las pilas secas y las pilas alcalinas. La pila seca es la celda galvánica más ampliamente utilizada, en donde una barra de grafito en la parte central se embebe en una sólido (cloruro de amonio junto con otros componentes como dióxido de manganeso), a su vez, todo ello se contiene dentro de un cilindro de cinc. Las hemi reacciones que se generan dentro de la pila son la oxidación del Cinc (Zn) y la reducción del Dióxido de Manganeso (MnO2) y se produce un voltaje de 1.5 V.
En el caso de las pilas alcalinas, se utiliza algún tipo de hidróxido que reemplazaría el cloruro de amonio y, por lo tanto, se produce la oxidación del Zn en medio básico y la reducción del Dióxido de Manganeso, también en medio básico. En este caso, se las considera más duraderas puesto que, cuando no están siendo utilizadas, no hay reacción alguna.
Pilas secundarias
En cuanto a las pilas secundarias, son las conocidas pilas recargables, que han ampliado su uso en pos de la menor generación de residuos poco amigables ambientalmente y, a su vez, beneficiando al usuario en la reducción de sus costos. Cuando estas pilas quieren ser recargadas, deben ser conectadas a una fuente de corriente externa, de ese modo, se genera la reacción óxido – reducción inversa y la pila queda “cargada”. Muchos aparatos electrónicos utilizan este tipo de pilas como por ejemplo las computadoras (notebooks) y autos.
En el caso de los autos, se utiliza un tipo de batería conocida como “acumulador de plomo” en donde la batería entrega la energía necesaria para el arranque del motor, y luego, mediante un alternador, la batería se recarga durante el uso y funcionamiento del mismo motor. Estas baterías se forman por celdas conectadas en serie y poseen un cátodo y un ánodo. El ánodo es un electrodo de plomo mientras que el cátodo es un electrodo de dióxido de plomo. Como en cualquier pila, los electrodos deben ser sumergidos en un electrolito, que en general consiste en una solución de ácido sulfúrico. De esta manera, se produce un voltaje de 2.05 V en cada una de las celdas, y dado que se conectan seis celdas en serie, la batería aporta una tensión de 12 V.
Pilas de combustible
En este caso, como su nombre lo indica, se requiere un suministro continuo de los reactivos de la reacción redox para producir la energía. Esta pila está formada por dos electrodos de algún material inerte y como reactivos se utiliza oxígeno e hidrógeno. Como bien sabemos, se requiere de un electrolito, que comúnmente es una disolución. En las semiceldas se burbujean los reactivos en estado gaseoso para formar agua como producto. Por ende, las semirreacciones que se llevan a cabo son la oxidación, en el ánodo, de hidrógeno molecular (H2) gaseoso para producir agua y, en el cátodo la reducción del oxígeno molecular combinado con agua que se obtienen hidroxilos como producto.
Son pilas muy potentes y robustas, capaces de generar electricidad con una eficiencia ampliamente superior a la de muchos motores de combustión interna. El potencial estándar de celda es de 1.23 V para los reactivos mencionados en este tipo de pilas.

Art. actualizado: Sept. 2022; sobre el original de diciembre, 2009.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.