Definición de Reacción Exotérmica

Ingeniera Química
Una reacción exotérmica es aquella que al producirse libera energía. Esa energía puede ser liberada en cualquiera de sus variantes, ya sea calor o luz.
Para estudiar los procesos propios de este fenómeno definimos la entalpía de una reacción (∆H), en donde, al hablar de reacciones exotérmicas ∆H queda definido como una magnitud menor a cero, ya que, por convención de signos, visto desde el punto de vista del sistema, este pierde energía. Esta magnitud que representa el flujo de energía térmica está definida para procesos a presión constante.
Ejemplos de reacciones exotérmicas
Existen muchos tipos de reacciones exotérmicas, típicamente, las oxidaciones son reacciones de este tipo. Inclusive, muchas reacciones propias del metabolismo de los seres vivos son reacciones exotérmicas involucradas en procesos vitales. Así mismo, al producir excesiva cantidad de calor pueden resultar agresivas para las personas, por lo que, en muchos casos, cuando deben ser llevadas a cabo, se toman los recaudos necesarios para evitar combustiones, explosiones e inclusive quemaduras.
– La combustión es un tipo de reacción que libera calor. Por ejemplo, la combustión del gas natural, principalmente metano que, en mezcla con oxígeno del aire, genera energía liberada en forma de calor, dióxido de carbono y agua. Gracias al calor liberado en las reacciones de combustión, el hombre ha podido sobrevivir al vivir en la intemperie, al calentarse con el fuego, cocinar sus alimentos y desarrollar motores a combustión que revolucionaron el mundo y sus tecnologías.
– La formación de amoníaco a partir de sus elementos nitrógeno a hidrógeno molecular. Dado que NH3 posee un estado de menor energía que los componentes que lo originan, ese exceso de energía es liberado en forma de calor.
– La neutralización de hidróxido de sodio y ácido clorhídrico, es una reacción exotérmica muy utilizada en laboratorios de prácticas de alumnos, ya que es una simple experiencia que puede realizarse en un vaso de polietileno y llevar a cabo una práctica de calorimetría. A partir de la diferencia de temperatura medible con un termómetro en el interior del vaso y conociendo las concentraciones de los reactivos y el volumen de cada solución colocado en el interior del vaso es fácilmente calculable el valor de la entalpía molar de reacción y comparable con estimaciones bibliográficas.
Interpretación
A partir del siguiente gráfico es fácilmente identificable el concepto de energía liberada. Si definimos la energía de activación como la energía necesaria para que ocurran choques efectivos entre moléculas de reactivos y haya reacción, es simplemente la diferencia entre el estado de energía del complejo activado y el estado de energía de los reactivos. Ahora bien, veamos el siguiente esquema:
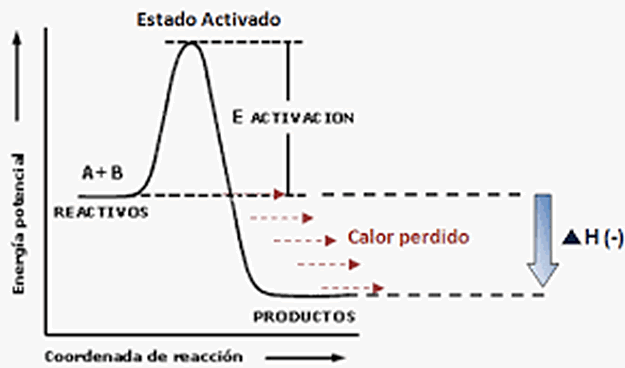
Cuando el estado energético de los productos es menor que el estado energético de los reactivos, esa energía es liberada en forma de calor. En ese caso, la reacción es un proceso exotérmico. Inversamente, cuando el estado energético de los productos es mayor al estado energético de los reactivos, se dice que la reacción es un proceso endotérmico, que requiere tomar energía de los alrededores y, dado que el sistema gana energía, se vuelve un valor positivo.
Muchas veces, veremos que el concepto de reacción exotérmica, toma al calor como un producto de reacción, y eso se puede describir de la siguiente manera:
A + B → C + D + q
Siendo A y B reactivos cualesquiera, C y D productos cualesquiera y q la energía liberada en forma de calor.
Cálculo de la energía desprendida en una reacción exotérmica
Previamente, introdujimos el concepto de variación de entalpía. Esta magnitud es la que nos permitirá ser estimada, para comprender cuánta energía libera una reacción que ocurre a presión a constante.
Por ejemplo, tomemos la reacción de formación de agua a partir de sus elementos, hidrógeno y oxígeno molecular:
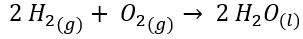
Se encuentran tabulados en bibliografía las entalpías de formación estándares de las sustancias puras en los estados de agregación mencionados. Por lo tanto, se conoce que:
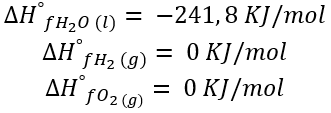
Si definimos a la entalpía estándar de reacción como la diferencia entre la sumatoria de las entalpías de formación de productos por sus coeficientes estequiométricos y la sumatoria de entalpías de formación de reactivos por sus coeficientes estequiométricos resulta:
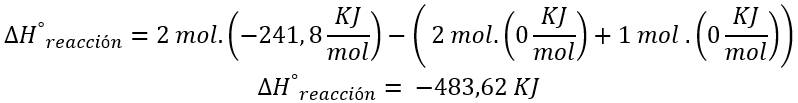
Energía liberada por la reacción para la producción de dos moles de agua.

Art. actualizado: Julio 2022; sobre el original de agosto, 2011.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.