Definición de Hidrocarburos

Ingeniera Química
Los hidrocarburos son compuestos orgánicos que sólo contienen átomos de Carbono e Hidrógeno. Un ejemplo típico es la gasolina, un compuesto orgánico derivado del petróleo y ampliamente utilizado como combustible.
Para comprender la raíz de la definición declarada debemos adentrarnos en el mundo de la Química Orgánica. Gracias a la existencia de un elemento fundamental que es el Carbono, existen muchos de los compuestos y sustancias que conocemos. El carbono es un elemento capaz de unirse con otros átomos de carbono y formar cadenas y estructuras cíclicas que dan lugar a una gran variedad de compuestos. Los compuestos cuya estructura está formada principalmente por enlaces C-C son compuestos orgánicos, dentro de la estructura también pueden encontrarse en minoría enlaces C-H, C-O, C-N y O-H.
¿Cómo se clasifican los hidrocarburos?
La clasificación más estudiada se basa en los enlaces carbono que forman la estructura de todo hidrocarburo. Si todos los átomos de carbono que lo forman están unidos entre sí mediante enlaces simples, el hidrocarburo se conoce como saturado o bien alcano. El uso industrial y comercial de los alcanos es enorme, desde su quema para uso como combustibles hasta como disolventes. Algunos ejemplos típicos de alcanos son:
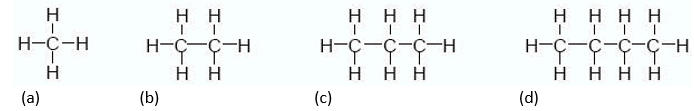
(a) Metano: básicamente se obtiene por la descomposición de residuos orgánicos a cargo de bacterias o bien por extracción de combustibles fósiles. Es el hidrocarburo de cadena más corta y comúnmente conocido como gas natural, es el componente mayoritario del gas que utilizamos en la cocina de nuestros hogares, el cual está formado además por etano y pequeñas proporciones de propano.
(b) Etano: es un excelente combustible formado por dos átomos de carbono y se obtiene mediante el procesamiento del gas natural en plantas petroquímicas (lo que se conoce como subproducto).
(c) Propano: cuando al petróleo se lo fracciona en sus distintos componentes se obtiene metano, etano, propano y butano. El propano posee tres átomos de carbono, lo que se considera volátil y permite ser obtenido en el tope de una torre de destilación fraccionada. Su uso más conocido es el de combustible como GLP (Gas Licuado de Petróleo), entre los que se consideran Propano y Butano.
(d) Butano: es un alcano formado por cuatro carbonos enlazados a hidrógenos. Su uso como combustible, también como GLP, es ampliamente aprovechado en la industria.
En los casos mencionados anteriormente, los hidrocarburos forman cadenas lineales; sin embargo, estos enlaces C-H también pueden acomodarse en forma de anillo y, a su vez, tener ramificaciones. Esto da lugar a lo que se conoce como isómeros, los cuales son compuestos que poseen idéntica fórmula molecular pero difieren en su estructura. Es decir, cuentan con igual cantidad de átomos Carbono e Hidrógeno pero estos se ubican diferente, lo que da lugar a nuevos compuestos. Veamos un ejemplo para clarificar el asunto:
El isómero lineal es el visto en (d) y se denomina n-butano mientras que el 2-metilpropano también posee fórmula química C4H10, la diferencia está en su estructura:
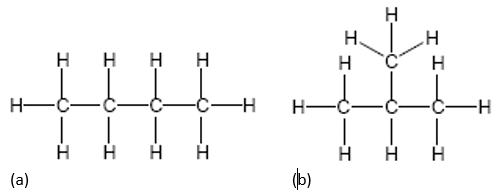
(a) n-butano: alcano de cadena lineal
(b) 2-metilpropano: su nomenclatura se debe a su estructura puesto que su cadena más larga (cadena base) está formada por 3 átomos de carbono (propano) y posee en el segundo átomo de carbono (posición 2) un grupo metilo (CH3). También es conocido como iso-butano por ser un isómero del butano de cadena lineal.
A medida que aumenta la cantidad de Carbonos enlazados, lógicamente aumenta el número de isómeros.
Por último, tenemos los hidrocarburos insaturados donde los átomos de carbono pueden estar unidos por enlaces dobles o triples. Dentro de este grupo de hidrocarburos tenemos tres tipos universalmente conocidos que describiremos brevemente: alquenos, alquinos y compuestos aromáticos.
Los hidrocarburos con uno o más enlaces dobles se denominan alquenos mientras que los alquinos contienen triple enlace entre átomos de carbono y, el último grupo, los hidrocarburos aromáticos, están definidos por su estructura cíclica con seis carbonos y enlaces dobles y como su nombre lo indica son reconocidos fácilmente por su aroma. Ejemplos típicos en cada caso son:
Eteno: alqueno también conocido como etileno, un plástico ampliamente utilizado en la industria, aunque también puede utilizarse eteno para fabricar etilenglicol, un anticongelante. Su estructura es: 〖CH〗_2= 〖CH〗_2
Propino: alquino también conocido como propileno. Su estructura es: CH≡C 〖CH〗_3.
Benceno: es el compuesto más sencillo dentro del grupo de los aromáticos, su fórmula es C6H6 y su estructura se puede representar de las siguientes maneras:
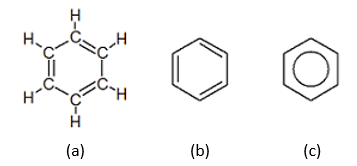
(a) Se sabe que hoy en día esta estructura no representa correctamente el benceno ya que no explica su carácter inerte.
(b) Representación esquemática de dobles enlaces alternados.
(c) Es la representación abreviada más exacta, donde cada ángulo representa un átomo de carbono y el círculo central los electrones en una nube compartidos.

Trabajo publicado en: Oct., 2021.
Referencias
Química, conceptos y aplicaciones. J. PHILLIPS, V. STROZAK, C. WISTROM. Mc Gran Hill.2007.Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.