Definición de Electronegatividad

Ingeniera Industrial, MSc en Física, y EdD
La electronegatividad se refiere al modo en el que un determinado átomo es capaz de atraer hacia él electrones en los enlaces químicos que ocurren durante un proceso de combinación con otro átomo.
Se han desarrollado escalas para expresar este parámetro, y cuanto mayor sea el valor de electronegatividad, significa que su capacidad de atraer electrones es mayor. En otras palabras, la electronegativa es una medida de referencia que indica cómo se reparten los electrones durante un enlace químico. De esta manera, si dos átomos poseen diferente electronegatividad, significa que los electrones se tienden a distribuir más próximos al de mayor electronegatividad.
Otra de las características a destacar de la electronegatividad es que su magnitud está relacionada con la estructura atómica, proporcionando una idea de la capacidad que tiene la carga nuclear para detectar si existen vacantes en el orbital más externo.
Origen de la electronegatividad
La literatura refiere las primeras aproximaciones del concepto de electronegatividad al físico-químico italiano Amedo Avogadro, quien en las primeras décadas de 1800 desarrolló una escala básica de este parámetro al momento de proponer una escala para alcalinidad y acidez y otra de oxigenecidad.
Más adelante, el químico de origen sueco, Jöns Jakob Berzelius fue quien por primera vez dio uso a la palabra “electronegatividad” al incorporarla en el desarrollo de la teoría electroquímica en la cual planteaba que los elementos químicos se ubican en una escala que va desde reaccionantes electronegativos hasta electropositivos.
Posteriormente, en el año de 1932, Linus Pauling realizó una de las contribuciones de mayor trascendencia para la electronegatividad, al proponer y publicar una escala de valores para la electronegatividad de los elementos químicos.
Escala de electronegatividad
La electronegatividad está relacionada con la afinidad electrónica, así como con el potencial de ionización de los átomos; de esta manera, aquellos átomos que poseen un elevado potencial de ionización aunado a una electroafinidad negativa, tendrán mayor electronegatividad. Esta característica le permite atraer hacia él los electrones pertenecientes a otros átomos y además mantener sus electrones cuando le ejercen del exterior una fuerza de atracción.
De acuerdo con el planteamiento anterior, es posible entonces conocer la electronegatividad de los elementos y comparar este valor con la de otros elementos, y para ello, se han desarrollado diversas escalas. Una de las más reconocidas y aplicadas es la generada por Linus Pauling, cuyos valores oscilan para los elementos de la tabla periódica entre 0,7 en el cesio y el mayor le corresponde al flúor con 4.
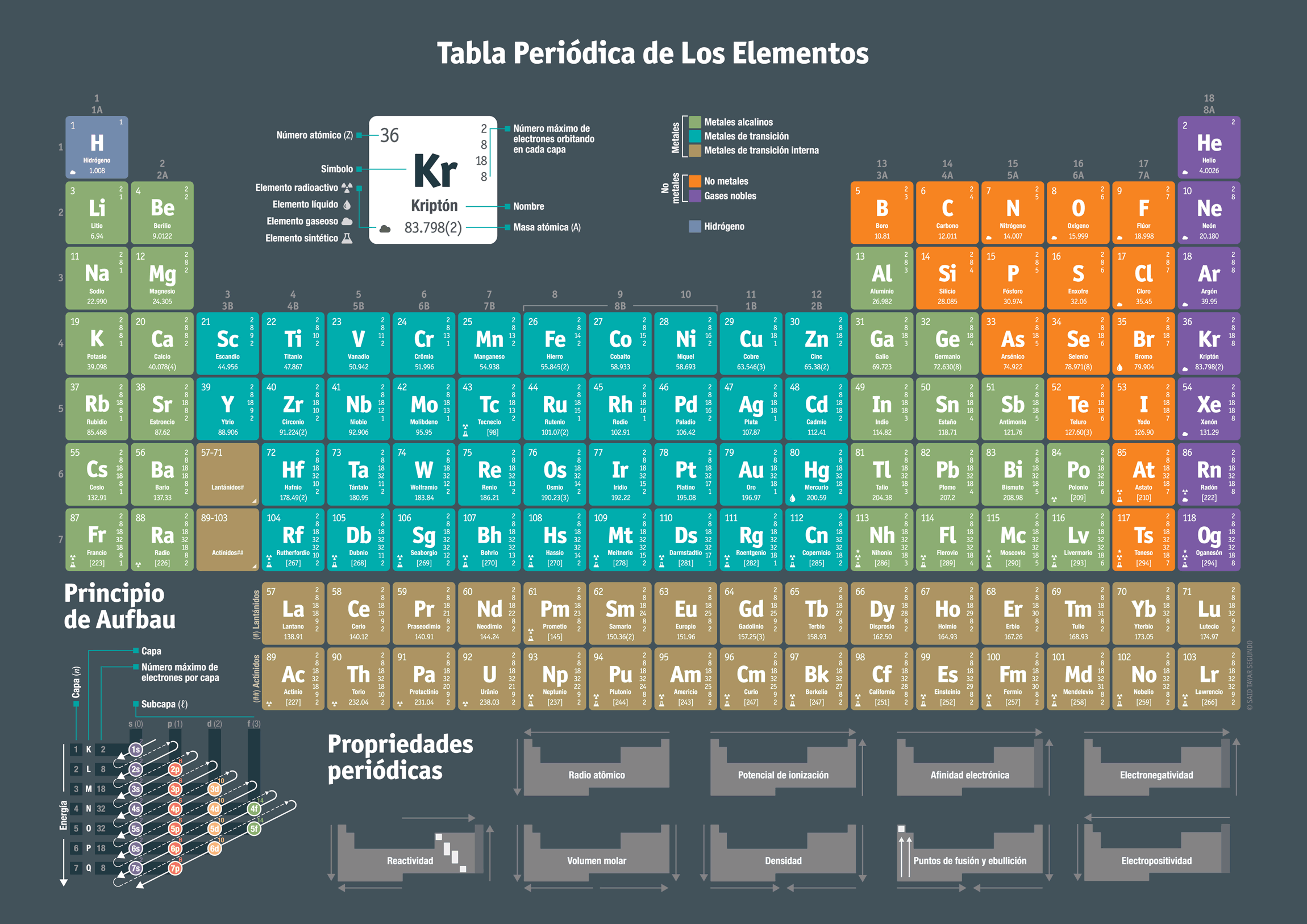
Tabla de electronegatividad según la energía de unión de los electrones de valencia.
Nota: cabe destacar que la electronegatividad no es posible medirla de manera directa, por lo que su valor se determina partiendo de la medición de otras propiedades atómicas, por ejemplo, la energía de enlace que posee el elemento.
En la escala de electronegatividad de Pauling, los valores son cantidades adimensionales/índices que suben en cada grupo, desde abajo en dirección hacia arriba, y en los períodos crecen de izquierda a derecha.
Pauling consideraba que la electronegatividad guarda una estrecha relación con el estado de oxidación, así pues, si un átomo presenta varios estados de oxidación, la electronegatividad será menor cuanto menor sea su estado de oxidación. Tal es el caso del aluminio, que en sus tres estados de oxidación posee los siguientes valores: Al(I) tiene electronegatividad 0,84, para Al(II) es de 1,63 y al Al(III) le corresponde 1,714.
Ahora bien, a pesar de que la escala de electronegatividad propuesta por Pauling es la más empleada, no significa que sea la única. Una de las más recientes fue publicada apenas en 2018 por los químicos R. Hoffmann, M. Rahm y T, Zeng considerando el valor promedio de la energía de unión para los electrones de valencia.
En esta escala los valores están expresados en unidades de energía por electrón, denotado como eV e-1, donde cada unidad en la escala de Pauling, equivale aproximadamente a 6 eV e-1.
Los tipos de enlace y su relación con la electronegatividad
Los tipos de enlaces pueden establecerse en función de la diferencia de electronegatividad entre los átomos, por ejemplo, si los dos átomos son iguales, tendrán la misma electronegatividad y la diferencia de este valor entre ambos átomos es nula, por lo que formarán un enlace covalente no polar y la repartición de electrones será de manera equitativa.
Por otra parte, si la diferencia de electronegatividad se encuentra en el rango de 0,4 a 1,7 en la escala de Pauling, se producirá un enlace de tipo covalente polar y evidentemente, los electrones tienden hacia el átomo con mayor electronegatividad.
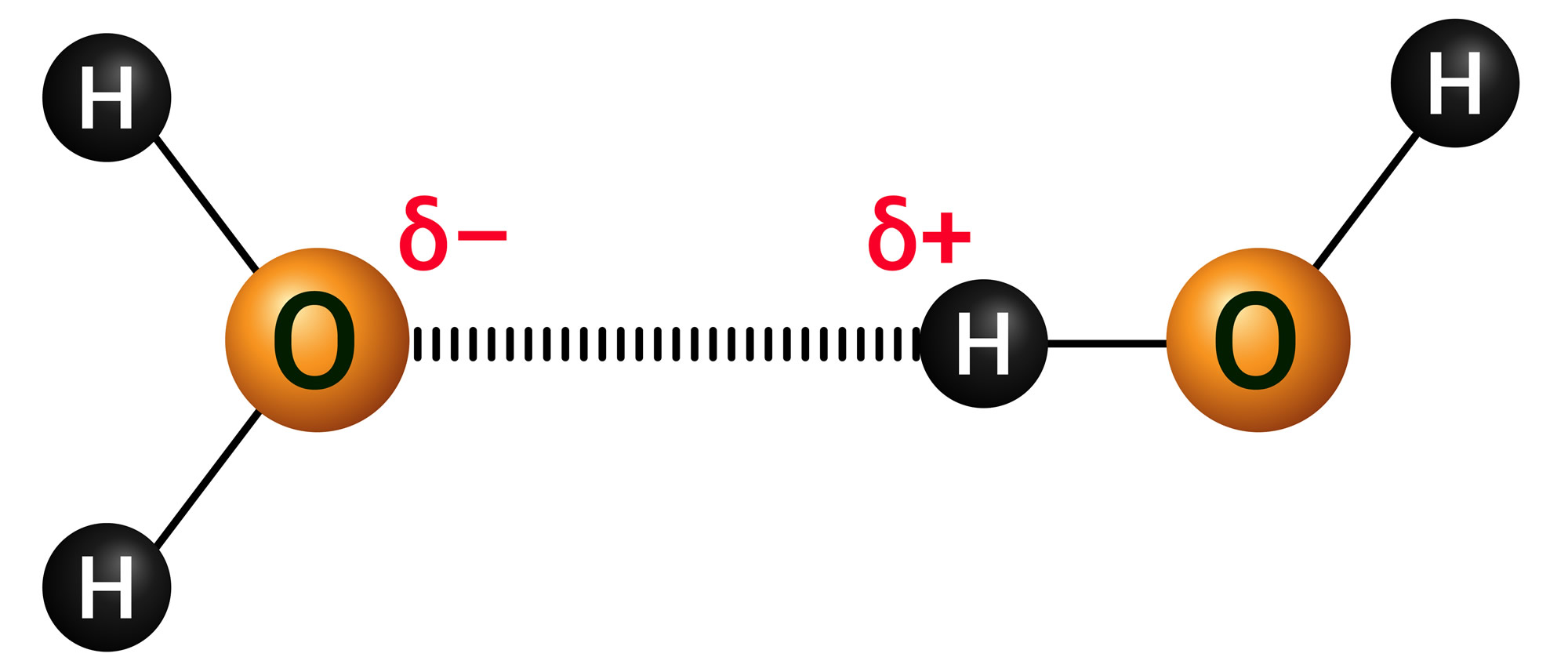
En la escala de Pauling el oxígeno posee una electronegatividad de 3,5 y el hidrógeno de 2,1 por lo que su diferencia da un valor de 1,4 y en consecuencia entre estos elementos se produce un enlace covalente polar.
En las situaciones en las que la diferencia de electronegatividad sea mayor o igual a 1,9 utilizando la escala de Pauling, se producirá un enlace de tipo iónico, lo que implica que se genera una transferencia de electrones, normalmente entre cationes y aniones. Este tipo de enlaces se asocia con la formación de sales.

Art. actualizado: Agosto 2022; sobre el original de diciembre, 2014.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.