Definición de Electrón

Ingeniera Industrial, MSc en Física, y EdD
Un electrón se define como una unidad indivisible cuyas dimensiones resultan menores a las del átomo, y actúa en interacción con este, razón por la que se lo califica como partícula subatómica, asimismo tiene una categoría elemental, porque no está unido a otro elemento subatómico, y tiene propiedad de carga eléctrica negativa, moviéndose entorno al átomo. El modelo atómico vigente es el cuántico, también conocido como modelo de Schrödinger. La palabra procede del inglés electron, constituido sobre el latín electrum, de ‘ámbar’ o bien ‘como el ámbar’, y el griego ἰόν (ión), de ‘ión’, con base en el griego ἤλεκτρον (ḗlektron), en referencia a una mezcla de oro y plata cuyas características se manifiestan en el ámbar, y, por lo tanto, remitía a dicho material, el cual era empleado en la antigüedad como material para hacer joyería y otros adornos debido a su capacidad para cargarse eléctricamente al ser frotado. El físico irlandés George Johnstone Stoney fue quien propuso el término científico en 1891 para referirse a la unidad elemental de carga eléctrica que se encuentra en los átomos.
El electrón es una de las pequeñísimas partículas que componen un átomo junto a los protones y a los neutrones. Los electrones quedan siempre por fuera del núcleo del átomo, compuesto por una combinación de protones y neutrones. Para mostrar cuán pequeño es el electrón, podemos decir que su masa es 1/1836 veces la de del protón. El nombre está asociado a la idea de que, gracias a su energía negativa, los mismos generan electricidad sobre el núcleo del átomo. El electrón pudo ser recién aislado y comprendido a mediados del siglo XIX cuando científicos comprendieron que en el átomo había una fuerza negativa que era atraída sobre el núcleo. Esta situación permitió entender que la electricidad que se genera en un átomo es resultante de la fuerza de atracción y repulsión que ejercen sobre sí mismos los protones y los electrones.
Los electrones son partículas que entran dentro del grupo de los leptones, es decir, aquellas que están sujetas a la fuerza electromagnética, a la fuerza gravitacional, etc. De todas las partículas conocidas como leptones, el electrón es el que más se ha llegado a comprender en su naturaleza, teniendo una cualidad estable. Además, junto con los protones y neutrones, el electrón es también considerada una partícula fundamental, ya que no puede ser dividida en unidades menores a sí misma. Su descubrimiento, análisis y comprensión ha sido sin duda alguna relevante para la vida del ser humano ya que esto ha permitido el descubrimiento de la electricidad, elemento vital para el estilo de vida actual. Junto con esto, miles de elementos y aparatos que basan su estructura en la electrónica han podido ser desarrollados con el tiempo con el fin de permitir al ser humano conocer mejor aquello que lo rodea y obtener a partir de eso niveles más altos de calidad de vida.
Características del electrón
 Según el modelo cuántico actual, los electrones tienen varias propiedades y características, entre las que se destacan:
Según el modelo cuántico actual, los electrones tienen varias propiedades y características, entre las que se destacan:
• El electrón se considera como una partícula subatómica que, al igual que la luz, exhibe características de onda y partícula en su comportamiento.
• Los electrones no tienen una ubicación precisa en el átomo, sino que se encuentran en un estado cuántico determinado por su función de onda, que representa la probabilidad de encontrar al electrón en una determinada posición y momento.
• Los electrones se disponen en niveles de energía discretos dentro del átomo, y solo pueden cambiar de nivel de energía emitiendo o absorbiendo fotones.
• Los electrones también tienen una carga eléctrica negativa que interactúa con la carga positiva del núcleo atómico.
En estos modelos, los electrones y su comportamiento se describen a través de la mecánica cuántica, que permite predecir las propiedades y comportamientos de los átomos a nivel subatómico.

Los electrones son partículas subatómicas fundamentales con propiedades muy específicas y características únicas que juegan un papel importante en la química, la electrónica y otras áreas de la física y la ciencia en general. El modelo actual fue elaborado por Schrödinger y Heisemberg considerando la dualidad onda partícula.
Evolución del concepto de electrón
El concepto del electrón ha cambiado a lo largo del tiempo con el desarrollo de nuevos modelos atómicos. A continuación, se describirá cómo ha evolucionado el concepto del electrón en las principales teorías o modelos atómicos a lo largo de la historia:
Modelo de Thomson (1904)
En el modelo atómico de Thomson, el electrón se concebía como una partícula subatómica que se encontraba incrustada en el átomo en forma de una estructura esférica uniformemente distribuida. Thomson propuso que la carga eléctrica negativa en el átomo estaba dispersa en toda la esfera, con los electrones incrustados en ella. Este modelo se denominó «modelo del pudín de pasas» o «modelo del pudin de ciruelas», debido a la similitud de la estructura del átomo con un pastel de ciruelas. Aunque este modelo no fue exacto en todos los detalles, constituyó un paso importante en la comprensión de la estructura atómica y el papel del electrón en ella. En el modelo de Thomson, los electrones se consideraban que estaban distribuidos en el átomo de manera similar a las pasas en un pudín.
Modelo de Rutherford (1911)
En el modelo atómico de Rutherford, el electrón se definía como una partícula subatómica con carga negativa que orbitaba alrededor del núcleo atómico localizado en el centro del átomo. Rutherford propuso que los átomos consistían en un núcleo pequeño y denso que contenía la mayor parte de la masa del átomo y estaba cargado positivamente, con los electrones orbitando alrededor del núcleo a una distancia considerable, similar a los planetas que orbitan alrededor del sol en el sistema solar. Cabe mencionar que este modelo no estaba en conflicto con las leyes de la física propuestas hasta el momento, pero la falta de explicación detallada de cómo los electrones permanecían en órbita estable y no caían en el núcleo provocó posteriores investigaciones y propuestas de nuevos modelos, como el de Bohr.
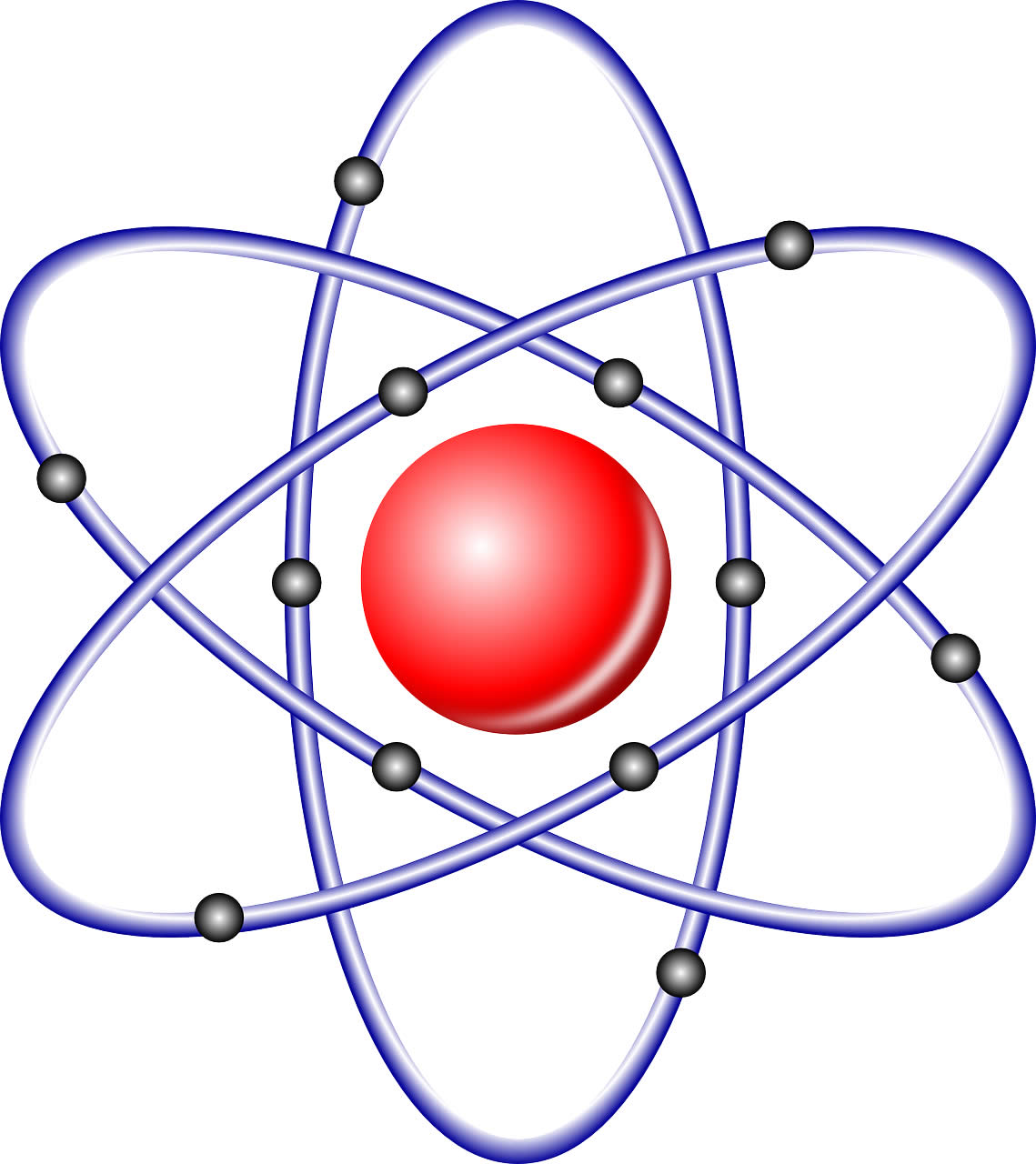
En el modelo atómico de Rutherford, el electrón se comportaba como una partícula con carga negativa en órbita alrededor del núcleo positivamente cargado, lo que les daba a los átomos su estructura general.
Modelo de Bohr (1913)
En el modelo atómico de Bohr, el electrón se consideraba como una partícula subatómica que orbitaba alrededor del núcleo atómico en órbitas circulares y estables, conocidas como «órbitas de Bohr». Además, este científico propuso que los electrones solo pueden tener ciertos niveles discretos de energía en estas órbitas, y que al saltar de una órbita a otra, los electrones emiten o absorben energía en forma de fotones. Esto explica por qué los átomos emiten luz en espectros discretos y no en espectros continuos.
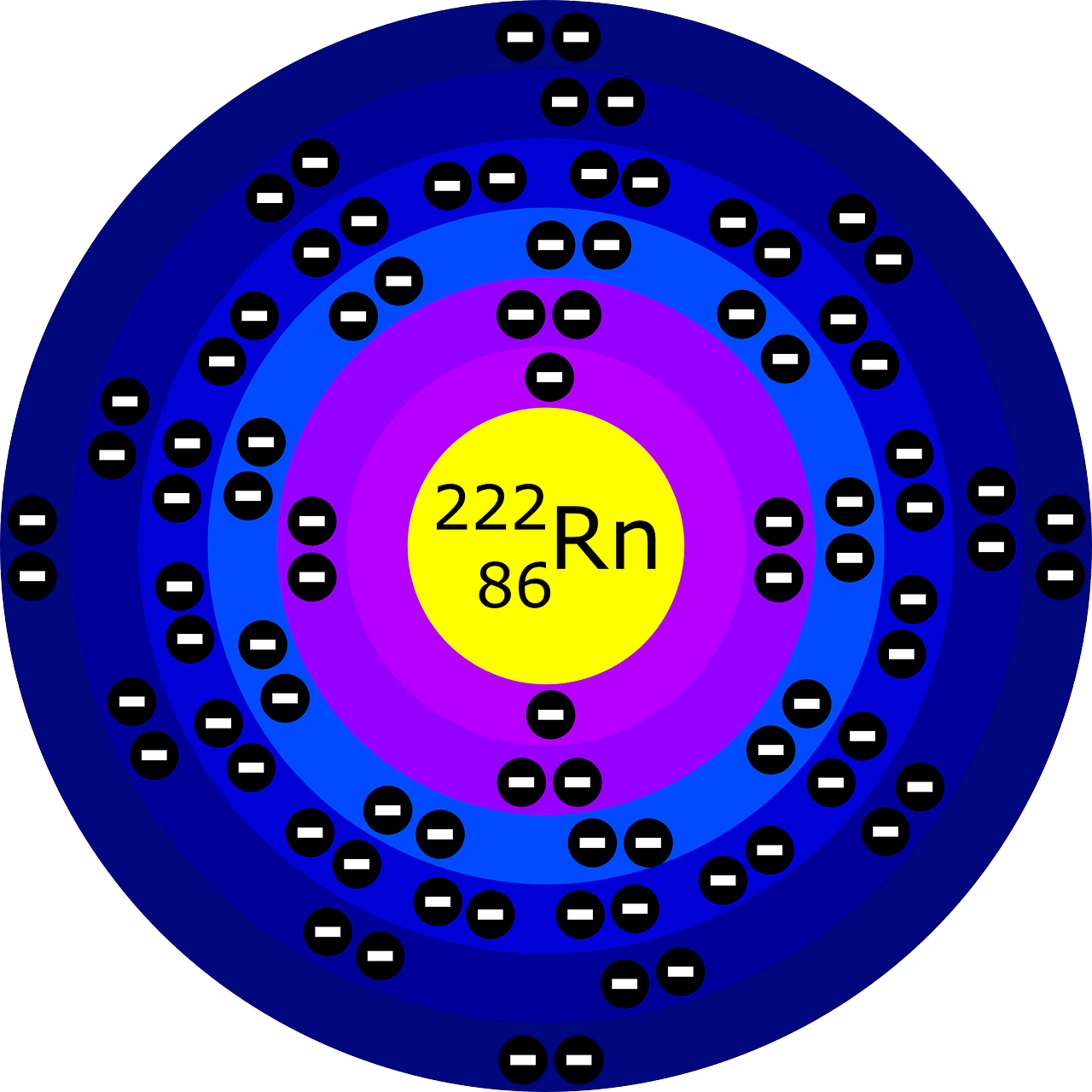
En este modelo, el electrón se describe como una partícula en órbita alrededor del núcleo en niveles discretos de energía, lo que permitió explicar varios fenómenos observados en la emisión y absorción de luz por los átomos. La imagen muestra una representación del elemento Radón (Rn)
Modelo de Schrödinger (1926 – actual)
En el modelo atómico de Schrödinger, el electrón se concibe como una onda de materia, en lugar de una partícula puntual como se creía en los modelos anteriores. Este modelo se basa en la teoría de la mecánica cuántica y describe a los electrones como una nube de probabilidad que rodea al núcleo atómico. Los electrones en este modelo son representados por funciones de onda que describen la probabilidad de encontrarlos en una determinada posición y momento. Por lo tanto, en el modelo de Schrödinger, no es posible determinar con precisión la posición exacta y el momento de un electrón en un átomo. En el modelo atómico de Schrödinger el electrón se concibe como una onda de materia que describe la probabilidad de encontrarlo en una determinada posición y momento.

Art. actualizado: Marzo 2023; sobre el original de julio, 2010.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.