Qué es Cambio Químico

Licenciada en Química
1. El cambio químico comprende la formación de nuevos elementos a partir de la alteración de las propiedades de la materia de un elemento inicial por medio de una reacción química. Este proceso en general es irreversible, y puede ocurrir a nivel macroscópico o microscópico.
Etimología: Cambio, por el latín tardío cambium, respecto del galo cambion.+ Químico, sobre el adjetivo del latín chymicus, en cuanto perteneciente a la química, sobre el árabe clásico kīmiyā', con base en el griego χυμεία (chymeía), en referencia a la manipulación de sustancias líquidas. Hacia mediados del siglo XVIII, para describir el estado de la materia, Documentado en 1694 en el área científica, a nivel físico, por el trabajo del británico John Locke (1632-1704), An essay concerning humane understanding.
Cat. gramatical: Sustantivo masc.
En sílabas: cam-bio + quí-mi-co.
Cambio Químico
Un cambio químico se refiere al proceso en el que una o varias sustancias se combinan para formar una o varias sustancias nuevas con propiedades físicas y químicas diferentes a las especies de partida. El cambio de la materia ocurre en términos composición, es decir, la proporción de átomos y como estos se encuentran unidos para dar lugar a las nuevas sustancias, para que esto ocurra es necesario que haya ruptura y formación de enlaces químicos sin que se modifiquen los átomos involucrados en los reactivos y los productos.
¿Cómo se puede expresar este fenómeno?
Los cambios químicos pueden expresarse mediante ecuaciones químicas, donde a través de símbolos y fórmulas químicas se representa información sobre lo que ocurre en la reacción. En general, la ecuación química tiene la siguiente forma:
\(Reactivos\; \to Productos\)
Del lado izquierdo de la flecha se encuentran las sustancias químicas que se combinan (reaccionan) para formar nuevas sustancias o productos de reacción, lado derecho de la flecha [1]. Por ejemplo, para la reacción de combustión completa de carbono (grafito) para formar dióxido de carbono se puede expresar de la siguiente manera:
\({C_{\left( s \right)}} + \;{O_{2\left( g \right)}} \to C{O_{2\left( g \right)}}\)
En la ecuación química, el signo “más” significa “reacciona con” y la flecha significa “produce” [1], de esta manera podemos leer la reacción como: un mol de carbono reacciona con un mol de oxígeno para producir un mol de dióxido de carbono. Las abreviaturas marcadas en subíndice que acompaña cada sustancia corresponde al estado de agregación de cada uno de ellos en la reacción: (s) sólido, (l) líquido, (g) gaseoso, (ac) en solución acuosa, (conc) concentrado y (dil) diluido.
A partir del análisis de la ecuación química se destacan algunos aspectos importantes:
1. Todas las sustancias químicas que intervienen en la reacción están expresadas con la fórmula molecular, es decir considerando todos los átomos que conforman la molécula.
2. Para medir las proporciones de las sustancias reaccionantes y los productos formados se utiliza la unidad de mol siguiendo el Sistema Internacional (SI), lo que determina átomos, moléculas u otras partículas que pueden estar dentro de una cantidad de sustancia, como átomos hay en 12g del isótopo de carbono-12. Este valor se conoce como el Número de Avogadro (NA) cuyo valor es 6.022 × 1023 [2], es decir, un mol de átomos de oxígeno equivale a 6.022 × 1023 átomos de oxígeno. Si lo relacionamos con la masa atómica de cada elemento, para el oxígeno su masa atómica es de 15,999uma y su masa molar (M) es de 15,999g, es decir, 6.022 × 1023 átomos de oxígeno pesa 15,999g.
3. Todos los elementos se encuentran en cantidades iguales tanto en los reactivos como en los productos, es decir, si hay un mol de carbono (sólido) como reactivo hay un mol de átomos de carbono en un mol de dióxido de carbono como producto; de forma similar con el oxígeno, si hay dos moles de átomos en un mol de oxígeno gaseoso como reactivo hay dos moles de átomos de oxígeno por mol de dióxido de carbono.
Esta información es muy útil para interpretar un cambio químico en términos de masa. La reacción anterior se puede interpretar de la siguiente manera: 12,01g reaccionan con 32,00g de oxígeno para formar 44,01g de dióxido de carbono.
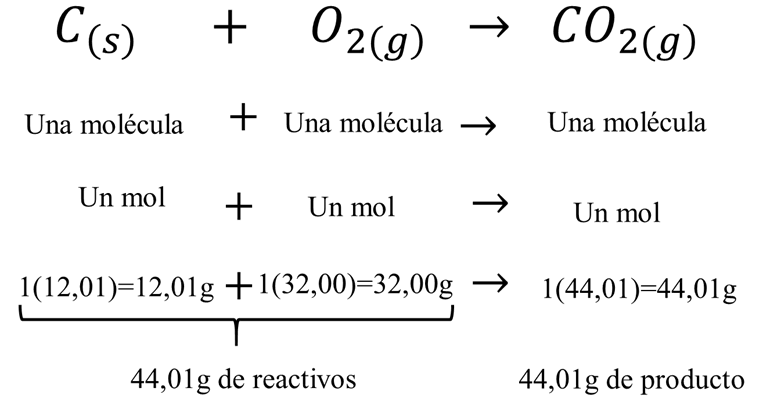
Con esto se comprueba el principio de conservación de masa propuesto por Lavoisier en 1774: “La masa total de las sustancias presentes después de una reacción química es la misma que la masa total de las sustancias antes de la reacción” [3].
Balance de ecuaciones químicas
La combustión de carbono (grafito) puede describirse como una reacción equimolar, pues la proporción en moles de reactivos y productos es igual (un mol de carbono, un mol de oxígeno y un mol de dióxido de carbono). Otras reacciones requieren proporciones diferentes, por ejemplo, en la reacción de combustión completa de gas butano (gas doméstico) para formar dióxido de carbono y agua la cual se representa de la siguiente manera:
\(2{C_4}{H_{10\left( g \right)}} + \;13{O_{2\left( g \right)}} \to 8C{O_{2\left( g \right)}} + 10{H_2}{O_{\left( l \right)}}\)
Es decir, dos moles de butano se combinan con trece moles de oxígeno en fase gaseosa para formar ocho moles de dióxido de carbono y 10 moles de agua. Para obtener las proporciones correctas de las moléculas (o moles) de reactivo para formar los productos se debe considerar que la cantidad de átomos de un elemento debe ser igual en los reactivos y productos. Esto es posible siguiendo el procedimiento descrito a continuación:
1. Se escriben los reactivos y productos considerando los elementos que lo conforman y la proporción de cada elemento en la sustancia, fórmula empírica en el caso de compuestos inorgánicos y fórmula molecular en el caso de los compuestos orgánicos. Para la reacción de combustión propuesta se tiene que:
\({C_4}{H_{10\left( g \right)}} + \;{O_{2\left( g \right)}} \to C{O_{2\left( g \right)}} + {H_2}{O_{\left( l \right)}}\)
2. El balanceo de la ecuación se desarrolla conforme la prueba de distintos coeficientes, enteros o fraccionarios, en función de igualar el número de átomos de cada elemento que se identifican a cada lado de la ecuación (balance por tanteo) partiendo de los elementos que solo aparecen en una sola vez en cada lado de la reacción. Ocasionalmente, resulta útil el siguiente orden de prioridad: (1) elemento metálico, (2) elemento no-metálico, (3) hidrógeno y (4) oxígeno:
\({C_4}{H_{10\left( g \right)}} + \;{O_{2\left( g \right)}} \to 4C{O_{2\left( g \right)}} + {H_2}{O_{\left( l \right)}}\) (4 átomos de C de cada lado)
\({C_4}{H_{10\left( g \right)}} + \;{O_{2\left( g \right)}} \to 4C{O_{2\left( g \right)}} + 5{H_2}{O_{\left( l \right)}}\) (10 átomos de H de cada lado)
\({C_4}{H_{10\left( g \right)}} + \;\frac{{13}}{2}{O_{2\left( g \right)}} \to 4C{O_{2\left( g \right)}} + 5{H_2}{O_{\left( l \right)}}\) (13 átomos de oxígeno de cada lado)
Es importante señalar que se pueden cambiar los coeficientes (los números que preceden a las fórmulas), pero no los subíndices (los números que forman parte de las fórmulas), pues cambiaría la identidad de la sustancia [1].
3. En caso de que se requieran solo números enteros en la ecuación química, esta se puede multiplicar por un factor tal que solo queden valores enteros y se verifica nuevamente la cantidad de átomos de cada lado de la ecuación química.
\(2*\left[ {{C_4}{H_{10\left( g \right)}} + \;\frac{{13}}{2}{O_{2\left( g \right)}} \to 4C{O_{2\left( g \right)}} + 5{H_2}{O_{\left( l \right)}}} \right]\)
\(2{C_4}{H_{10\left( g \right)}} + \;13{O_{2\left( g \right)}} \to 8C{O_{2\left( g \right)}} + 10{H_2}{O_{\left( l \right)}}\)
Átomos / Reactivos / Productos
C / 8 / 8
H / 20 / 20
O / 26 / 26
Cambios de energía en los cambios químicos
La ruptura y formación de enlaces químicos durante una reacción, lleva consigo la formación de nuevos compuestos y energía liberada o absorbida en forma de calor, el cambio neto se mide a partir de la entalpia de reacción \( \Delta {H_r}\). De acuerdo a esto, los cambios químicos se clasifican en:
– Procesos exotérmicos: si la reacción química libera calor, es decir, se transfiere energía térmica hacia los alrededores. En este caso, la energía de los reactivos es mayor que la energía de los productos, por lo tanto, el valor de \( \Delta {H_r} < 0\). Por ejemplo, en la reacción de combustión de hidrógeno gaseoso con oxígeno para la formación de agua: \(2{H_{2\left( g \right)}} + {O_{2\left( g \right)}}\; \to 2{H_2}{O_{\left( l \right)}}\;\;\;\;\;\; \Delta {H_r} = \; - 571,66\;kJ\) - Procesos endotérmicos: si la reacción química los alrededores deben suministrar calor al sistema. Para estos procesos ocurre lo contrario a los procesos exotérmicos, la energía de los reactivos es menor que la energía de los productos, por lo tanto, el valor de \( \Delta {H_r} > 0\). Por ejemplo, en la reacción de descomposición de óxido de mercurio (II) a altas temperaturas:
\(2Hg{O_{\left( s \right)}} \to 2H{g_{\left( l \right)}} + \;{O_{2\left( g \right)}}\;\;\;\;\;\; \Delta {H_r} = \; + 181,6\;kJ\)

Art. actualizado: Agosto 2022; sobre el original de septiembre, 2012.
Referencias
[1] R. Chang, Química, Décima Ed., McGraw-Hill/Interamericana Editores, México, 2010.[2] B. Mahan, R. Myers, Química. Curso Universitario, Cuarta Ed., Addison-Wesley Iberoamericana, USA, 1990.
[3] R. Petrucci, G. Herring, J. Madura, C. Bissonnette, Química General, Décima Ed., Pearson Education S.A., Madrid, 2011.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.